Hem bilim camiasında hem de tüm dünyadan geniş bir kamuoyunda merakla beklenen 2024 yılı Nobel Bilim Ödülleri, geçtiğimiz ayın başlarında açıklandı. Nobel Fizyoloji veya Tıp Ödülü’ne gen etkinliğinin düzenlenmesine ilişkin temel bir prensibi keşfettikleri için Victor Ambros ve Gary Ruvkun; Nobel Fizik Ödülü’ne günümüzün güçlü makine öğrenme sistemlerinin temellerinin atılmasına yaptıkları katkılardan dolayı John Hopfield ve Geoffrey Hinton; Nobel Kimya Ödülü’ne ise tamamen yeni proteinler tasarlamayı sağlayan hesaplamalı bir yöntem geliştirdiği için David Baker ile proteinlerin üç boyutlu karmaşık yapılarının tahmin edilmesini sağlayan bir yapay zekâ modeli geliştirdikleri için Demis Hassabis ve John Jumper adlı bilim insanları layık görüldü. Gelin çığır açıcı bilimsel gelişmelere imza atan bu bilim insanlarının, onları Nobel Ödülü’ne götüren bilim hikayelerine kısaca göz atalım.
2024 Nobel Fizyoloji veya Tıp Ödülü:
MikroRNA’ların ve Gen Düzenleme Mekanizmasındaki Rollerinin Keşfi

Ill. Niklas Elmehed - Nobel Prize Outreach
Victor Ambros (solda) ve Gary Ruvkun (sağda)
Bu yılın Nobel Fizyoloji veya Tıp Ödülü, canlı hücrelerde gen etkinliğinin kontrolünde etkili olan hayati bir düzenleme mekanizmasının keşfiyle ilgili. DNA üzerindeki genetik bilgi, transkripsiyon adı verilen süreçle mRNA moleküllerine aktarılır ve mRNA’nın taşıdığı genetik bilgi de daha sonra ilgili genin kodladığı proteinin sentezlenmesine yani üretilmesine kılavuzluk eder. 20. yüzyılın ortalarından itibaren en temel bilimsel keşiflerden bazıları, bu süreçlerin nasıl çalıştığına ışık tuttu.
Organlarımız ve dokularımız farklı hücre tiplerinden oluşur. Tüm hücrelerimiz DNA’larında tamamen aynı genetik bilgiyi taşır. Ancak her hücrede aynı proteinler üretilmez.
Farklı tipteki hücrelerde üretilen protein repertuvarları birbirinden farklıdır. Peki bu nasıl mümkün olabilir? Bunun yanıtı gen etkinliğinin, yani hangi hücrelerde hangi genlerin kodladığı proteinlerin üretileceğinin hassas bir şekilde düzenlenmesinde yatar. Her hücre tipinin kendine has bir protein repertuvarına sahip olması, örneğin kas hücrelerinin, ince bağırsak hücrelerinin ve farklı tipteki sinir hücrelerinin kendi özelleşmiş işlevlerini gerçekleştirebilmesine imkân verir. Dahası, hücresel işlevlerin vücudumuzdaki ve çevredeki şartlara uyum sağlayabilmesi için gen etkinliğinin sürekli hassas şekilde ayarlanması gerekir. Eğer genlerin düzenlenmesinde aksaklıklar olursa bu durum; kanser, şeker hastalığı ve otoimmün hastalıklar gibi ciddi hastalıklara neden olabilir. Bu yüzden gen etkinliğinin nasıl düzenlendiğinin anlaşılması uzun yıllardır önemli bir hedef konumunda.
1960’larda transkripsiyon faktörü adı verilen özel proteinlerin, transkripsiyon sırasında DNA üzerindeki özel bölgelere bağlanarak hangi mRNA’ların üretileceğini belirlediği, dolayısıyla gen etkinliğini kontrol ettiği keşfedilmişti. Bu keşiften sonra uzun bir süre genlerin düzenlenmesine ilişkin temel prensiplerin anlaşılmış olduğu düşünüldü. Ancak bu yıl Nobel kazanan iki bilim insanının keşifleri, genlerin düzenlenmesinde etkili yeni bir mekanizma ortaya koydu.
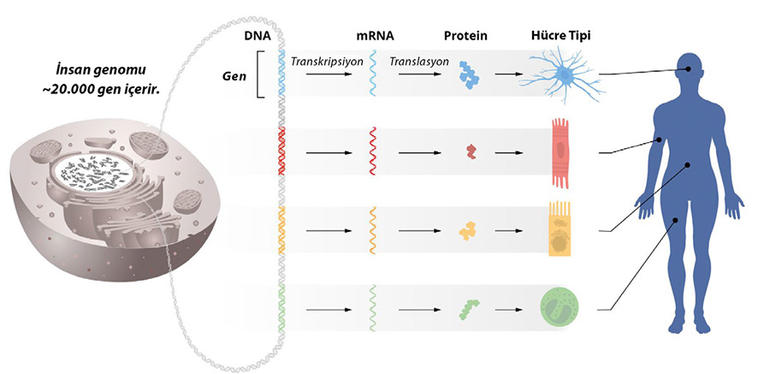
DNA bulunur. Bu da genlerin etkinliğinin, her bir spesifik hücre tipinde sadece doğru genlerin aktif halde olmasını sağlamak üzere hassas bir şekilde düzenlenmesini gerektirir.
Ambros ve Ruvkun, 1980’lerin sonlarında 2002 Nobel Ödülü sahibi Robert Horvitz’in laboratuvarında yaptıkları doktora sonrası araştırmalarda Caenorhabditis elegans adlı model organizma üzerinde çalıştı. Bir yuvarlak solucan (nematod) türü olan C. elegans, boyutu çok küçük olmakla birlikte daha büyük boyutlu ve karmaşık canlılarda da bulunan sinir ve kas hücreleri gibi özelleşmiş pek çok hücre tipine sahip. Bu yüzden de çok hücreli canlılarda dokuların nasıl gelişip olgunlaştığını araştırmak için çok uygun bir model organizma.
Ambros ve Ruvkun, çeşitli hücre tiplerinin doğru zamanda gelişmesini temin etmek üzere farklı genetik programların ne zaman etkinleştirileceğini kontrol eden genlerle ilgileniyordu. Gelişimleri sırasında genetik programlarının etkinleşme zamanlamasında bozukluk sergileyen lin-4 ve lin-14 adlı iki mutant C. elegans soyunu inceliyorlardı. İki araştırmacı, mutasyonlu genleri belirlemek ve bunların işlevlerini anlamak istiyordu.
Ambros, daha önce lin-4 geninin lin-14 geni üzerinde negatif (genin etkinliğini bloke eden) bir düzenleyici olduğunu göstermişti. Ancak lin-14’ün etkinliğinin nasıl bloke olduğu bilinmiyordu. Bu iki mutantın ve aralarındaki olası ilişkinin peşine düşen Ambros ve Ruvkun, bu gizemi çözmek üzere kolları sıvadı.
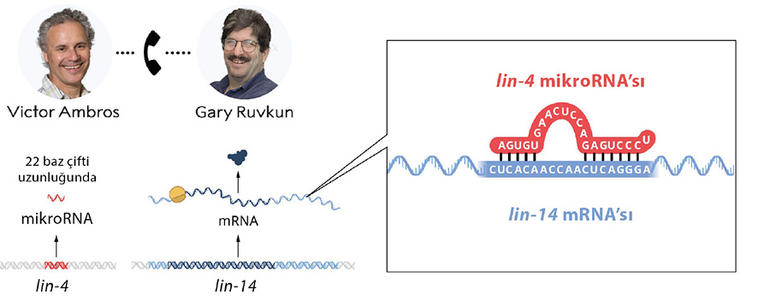
Ambros lin-4’ün çok küçük bir RNA molekülünü, bir mikroRNA’yı kodladığını, herhangi bir protein kodlamadığını keşfetti. Ruvkun da lin-14 genini klonlayarak, yani izole edip çoğaltarak inceledi. İki araştırmacı lin-4 mikroRNA’sının lin-14 mRNA’sındaki tamamlayıcı bir diziye karşılık geldiğini fark etti.
Ambros, doktora sonrası araştırmalarından sonra Harvard Üniversitesinde kurduğu laboratuvarında lin-4 mutantına odaklandı. Lin-4 genini klonlayarak, yani canlıdan izole edip çoğaltarak incelediğinde beklenmedik bir bulguyla karşılaştı. Lin-4 geninden sıra dışı ölçüde kısa bir RNA molekülü üretiliyordu ve bu gen protein üretilebilecek bir koddan yoksundu. Bu şaşırtıcı sonuçlar, lin-4’ten üretilen bu kısa RNA’nın lin-14’ün bloke edilmesinden sorumlu olabileceğini düşündürüyordu. Peki bu nasıl olabilirdi?
Bu sırada Ruvkun da Massachusetts Genel Hastanesi ve Harvard Tıp Okulu bünyesinde yeni kurduğu laboratuvarında lin-14 geninin nasıl düzenlendiğini araştırıyordu. Ruvkun, genlerin düzenlenmesine ilişkin o dönemki kabullerden farklı olarak lin-4 tarafından bloke edilen şeyin lin-14’ten mRNA üretilmesi olmadığını, engellemenin proteinin üretilmesi aşamasında gerçekleştiğini gösterdi. Deneyler ayrıca lin-14 genindeki belirli bir parçanın, bu genin lin-4 tarafından bloke edilmesi için gerekli olduğunu gösteriyordu. İki bilim insanı, bulgularını karşılaştırdıklarında çığır açacak olan o keşfe yaklaşmıştı. Kısa lin-4 dizisi, lin-14 mRNA’sı üzerindeki kritik bölgede bulunan tamamlayıcı bir diziyle eşleşiyordu. İkili, lin-4 mikroRNA’sının lin-14 genini, lin-14’ten üretilen mRNA’daki tamamlayıcı dizilere bağlanmak suretiyle bloke ettiğini deneylerle kanıtladı. Böylece genlerin düzenlenmesine ilişkin, daha önce bilinmeyen bir RNA türü olan mikroRNA tarafından gerçekleştirilen yeni bir mekanizma keşfedilmiş oldu!
Daha sonra yapılan araştırmalarda mikroRNA’ların hayvanlar aleminde yaygın olduğu, hayvanlar aleminin farklı alt dallarında ortak görülen çok sayıda mikroRNA olduğu keşfedildi. Bugün insanlarda mikroRNA’ları kodlayan binden fazla gen bulunduğu ve gen etkinliğinin mikroRNA’lar yoluyla düzenlenmesinin çok hücreli canlılarda genelgeçer bir mekanizma olduğu biliniyor. Genetik araştırmalar, mikroRNA’lar olmadığında hücrelerin ve dokuların normal olarak gelişemediğini gösteriyor. MikroRNA’lar tarafından gerçekleştirilen düzenlemedeki anormallikler, kanserlerin oluşmasında etkili olabiliyor. Ayrıca insanlarda mikroRNA’ları kodlayan genlerde doğuştan duyu kaybı, göz ve kemik hastalıkları gibi sağlık sorunlarına yol açabilen mutasyonlar bulundu.
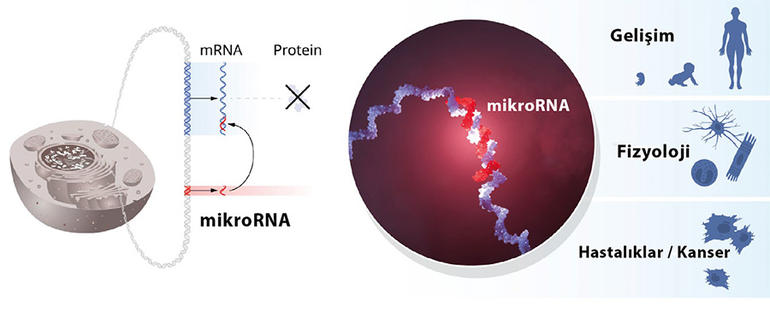
MikroRNA’nın çığır açıcı keşfi şaşırtıcıydı. MikroRNA temelli düzenleme mekanizması, gen etkinliğinin düzenlenmesine ilişkin resme yeni bir boyut ekledi.
2024 Nobel Fizik Ödülü:
Makine Öğrenmesi Yöntemlerinin Geliştirilmesi

Ill. Niklas Elmehed - Nobel Prize Outreach
John Hopfield (solda) ve Geoffrey Hinton (sağda)
Nobel Fizik Ödülü’nün 2024 yılındaki sahipleri Princeton Üniversitesinden John Hopfield ve Toronto Üniversitesinden Geoffrey Hinton oldu. İsveç Kraliyet Bilim Akademisinden yapılan açıklamada araştırmacıların, fiziksel metotlar kullanarak geliştirdikleri yöntemlerle makine öğrenmesinin temellerini atmaları sebebiyle ödüle layık görüldükleri açıklandı.
Bilgisayarların düşünme yetisi yoktur. Ancak günümüzde yapay zekâ olarak adlandırılan bilgisayar programları, insanların öğrenme ya da hafızaya alma yetilerini taklit edebiliyor.
Klasik yazılımların çalışması, bir “yemek tarifini” kullanarak yemek pişirmeye benzer. Programa gerekli malzemeleri verirsiniz, program da tarifi adım adım takip ederek sonuca ulaşır. Makine öğrenmesinde ise bilgisayarlar, yerine getirecekleri görevi en iyi şekilde yapmaları için çok sayıda örnekle eğitilir. Bu sayede yemek tarifi benzeri talimatları takip ederek yerine getirmeleri neredeyse imkânsız görevleri başaracak hâle gelirler. Örneğin, bir resimdeki nesneleri ayırt etmek gibi.
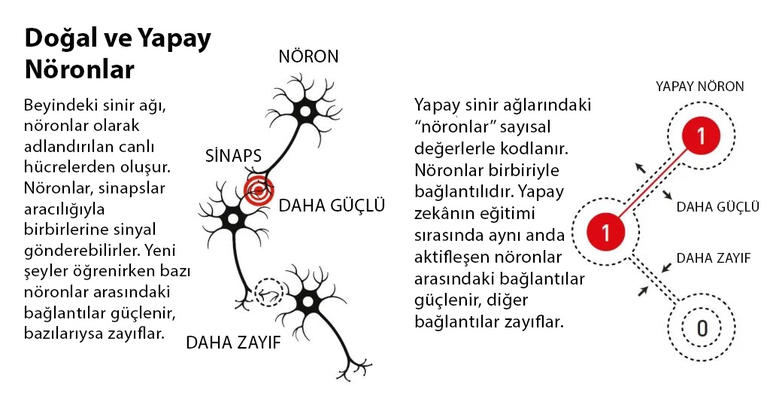
Günümüzde makine öğrenmesi denildiğinde akla gelen ilk teknoloji, insan beyninin işleyişini taklit eden yapay sinir ağları oluyor. Bu yapay zekâ uygulamaları, birbirine sinapslarla bağlı nöronlar gibi organize olmuş “yapay nöronlardan” oluşur. Makine öğrenmesi sırasında yapay nöronlar arasındaki sinapslar güçlendirilir ya da zayıflatılır ta ki uygulama, yerine getirmesi istenen görevi başaracak hâle gelinceye kadar.
John Hopfield, makine öğrenmesi üzerine çalışmalar yapmaya 1980’lerin başlarında başladı. Çalışmalarındaki esin kaynağı, aldığı fizik eğitimiydi. Hopfield ağlarında uygulama, kendine verilen bir görüntüyü tanımlamak için “enerjiyi minimize eden” bir algoritmayı takip eder. Bu algoritmanın nasıl çalıştığını şöyle bir örnekle daha iyi anlayabiliriz. Üzeri irili ufaklı tepelerle kaplı bir arazi olduğunu düşünelim. Bu arazinin üzerine bırakılan bir top, bir çukurun dibine inip durana kadar yuvarlanmaya devam eder. Topun ulaştığı çukur noktası, potansiyel enerji açısından bir yerel minimumdur. Hopfield ağlarının eğitim sürecinde engebeli bir arazi oluşturulur.
Program, kendisine verilen bir görüntünün ne olduğunu tespit etmek için topu (görüntüyü) engebeli arazide yuvarlanmaya bırakır. Topun ulaştığı son nokta, görüntünün ne olduğunu söyler. Hopfield ağları, kısmen bozuk ya da silinmiş görüntüleri de sınıflandırmayı başarır.
Geoffrey Hinton ise yapay zekâ üzerine yaptığı çalışmalarda istatistiksel mekanikten yararlandı. İstatistiksel fizik, çok sayıda bileşenden oluşan sistemlerin kolektif özellikleri ile ilgilidir. Hinton, çalışmalarında 19. yüzyılda Ludwig Boltzmann tarafından türetilmiş bir sistemde toplam enerjiye bağlı olarak hangi durumların hangi olasılıklarla ortaya çıkacağının tahmin edilmesine yarayan bir eşitlikten yararlandı. Hinton’un geliştirdiği Boltzmann makinesi, “üretken yapay zekâ”nın ilk örneklerinden oldu.
Günümüzün yapay zekâ uygulamaları, her birinde çok sayıda nöron bulunan çok sayıda katmandan oluşuyor. Bu uygulamalara ‘‘derin sinir ağları’’, bu uygulamaların eğitilme biçimine ise ‘‘derin öğrenme’’ deniyor.

Thom Leach / Science Photo Library
Yapay sinir ağlarının bir betimlemesi
Hopfield ve Hinton, çalışmalarında yapay zekâyı geliştirmek için fizikten yararlanmıştı. Günümüzde ise yapay zekâ uygulamaları genellikle fiziksel araştırmalarda kullanılıyor. Örneğin, Higgs Bozonu keşfine giden yolda devasa veri setleri yapay zekâ ile analiz edilmişti. Öte gezegen araştırmaları, yeni malzemelerin keşfi, proteinlerin yapısının tahmin edilmesi ya da verileri parazitlerden arındırmak da günümüzde yapay zekânın bilimsel araştırmalarda yararlı olduğu alanlardan bazıları.
2024 Nobel Kimya Ödülü:
Proteinlerin Yapılarını Tahmin Edebilen Bir Yapay Zekâ Programı Geliştirilmesi ve Yeni Proteinlerin Tasarlanması

Ill. Niklas Elmehed - Nobel Prize Outreach
David Baker (solda), Demis Hassabis (ortada) ve John M. Jumper (sağda)
Nobel Kimya Ödülü’nün 2024 yılı sahipleri David Baker, Demis Hassabis ve John M. Jumper oldu. Google DeepMind araştırmacıları Demis Hassabis ve John M. Jumper, proteinlerin üç boyutlu yapılarını tahmin edebilen yapay zekâ programları geliştirdikleri için ödüllendirilirken Washington Üniversitesinden David Baker, yeni proteinler tasarlama konusundaki çalışmalarından dolayı ödüle layık görüldü.
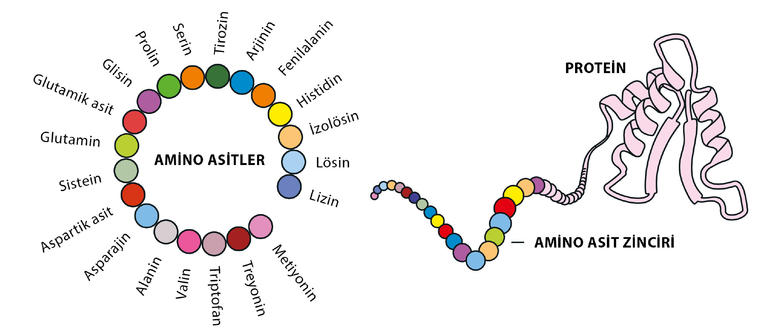
Canlı sistemlerinde birçok farklı görevi yerine getiren çok sayıda protein bulunur. Proteinlerin yapı taşı olan amino asitlerin doğada keşfedilmiş yüzlerce türü bulunsa da tüm canlı organizmalar tarafından kullanılan yirmi çeşit amino asit vardır.
Johan Jarnestad/The Royal Swedish Academy of Sciences
Bir protein onlarca ya da binlerce aminoasitten oluşabilir. Amino asit zinciri, her bir proteine özel üç boyutlu belirli bir yapı biçiminde kıvrılarak proteini işlevsel hâle getiren biçime bürünür.
Peptit bağlarıyla birbirine bağlanan amino asitler, bir polipeptit zinciri oluşturur. Polipeptit zincirinin bölümleri arasındaki kimyasal bağlanma, proteini bir arada tutmaya ve ona üç boyutlu şeklini vermeye yardımcı olur. Bir proteinin özelliklerinin ve işlevinin belirlenmesi, üç boyutlu şekline bağlıdır.
Amino asitlerden fonksiyonel bir proteinin oluşumu birincil, ikincil, üçüncül ve dördüncül yapılar olarak adlandırılan birkaç aşamada gerçekleşir. Birincil yapı, amino asitlerin bir proteini oluşturmak üzere birbirine bağlandığı benzersiz polipeptit zincirlerini tanımlar. Proteinlerin birincil yapısı onları kodlayan genler tarafından belirlenir. Bu durum, bir proteinde bulunan toplam amino asit sayısının, çeşidinin ve sıralamasının, DNA’daki genetik kodlara göre belirlendiği anlamına gelir. İkincil yapı, polipeptit zincirinin belirli bölgelerinde oluşan düzenli üç boyutlu yapıları ifade ederken üçüncül yapı, zincirin tamamının üç boyutlu yapısıdır. Dördüncül yapı ise üçüncül yapısını kazanmış iki veya daha fazla proteinin bir araya gelerek oluşturduğu kompleks yapılardır. Proteinlerin işlevsel formlarını ve üç boyutlu yapılarını kazandığı protein katlanması, bu dört aşamayı içeren hayli karmaşık bir süreçtir.
Canlı organizmaların temel biyomoleküler yapı taşı olan proteinlerin üç boyutlu yapılarını kazandığı katlanma süreci, moleküler biyolojinin en karmaşık konularından biri. Bir proteinin katlanmış yapısını tahmin etmek, tüm bu sürecin çok fazla olasılık dâhilinde gerçekleşmesinden dolayı hayli zor. Ancak proteinlerin işlevini daha iyi anlamak için önemli olan bu süreç, birçok hastalık türüne neden olan etkenlerin belirlenmesinden yeni tür ilaçların keşfedilmesine kadar çok sayıda fayda sağlayabileceği için yıllardır üzerinde çalışılan bir konu.
Yakın zamana kadar bilim insanları, proteinlerin üç boyutlu yapısını, yalnızca X-ışını kristalografisi ve kriyo-elektron mikroskobu gibi teknikler kullanarak görüntüleyebiliyordu. Ancak bu yöntemler, sınırlı sayıda proteinler için geçerliydi ve sınırlı sayıda görüntü elde edilebiliyordu.
Proteinin nasıl katlandığına dair tüm bilginin amino asit dizisinde olması gerektiğini gösteren çalışmalarla birlikte üç boyutlu yapının tahmin edilebileceğine dair fikirler oluştu. 1990’larda ABD’deki Maryland Üniversitesinden John Moult ve meslektaşları, protein yapısının modellenmesinde en iyi uygulamaları belirlemek için iki yılda bir tekrarlanan ‘’protein yapısı tahminlerinin kritik değerlendirmesi’’ (CASP) adlı bir yarışma başlattı. Yarışma kapsamında katılımcılara, yapıları geleneksel yöntemlerle henüz belirlenmiş hedef proteinlerin amino asit dizileri verildi ve katılımcılardan bu proteinlerin üç boyutlu yapılarını modellemeler yoluyla tahmin etmeleri istendi. Ancak bu tahmin problemini çözmek, beklenildiğinden çok daha zordu. Tahminler ve gerçek yapılar arasındaki benzerliğin sağlanmasında ilerleyen dönemlerde de pek umut verici sonuçlar elde edilemedi.
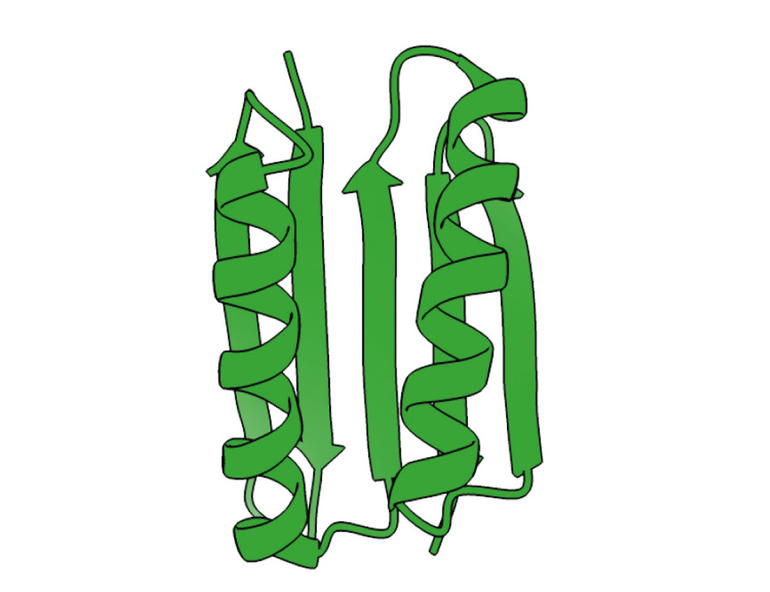
Terezia Kovalova/The Royal Swedish Academy of Sciences
Var olan ve bilinen tüm proteinlerden tamamen farklı olan ilk protein Top7
Daha sonra Demis Hassabis’in kurucu ortağı olduğu DeepMind tarafından geliştirilen, proteinlerin üç boyutlu yapısını dikkate değer bir doğrulukta tahmin edebilen, derin öğrenme tabanlı yapay zekâ programı AlphaFold’un geliştirilmesi, sürece ivme kazandırdı. Önceki yıllarda gerçekleşen CASP yarışmalarında protein yapıları en iyi ihtimalle %40 doğrulukla tahmin edilebilirken AlphaFold ile bu oran %60’lara çıktı. Ancak başarı için tahminle hedef protein arasındaki benzerlik oranının en az %90 doğrulukta olması gerekiyordu. Daha sonra John M. Jumper’ın da dâhil olduğu ekip, AlphaFold’un algoritmasını daha da geliştirerek bir üst versiyon AlphaFold2’yi piyasaya sürdü. Ekip, AlphaFold2’yi bilinen tüm protein yapıları ve amino asit dizilerine ait veri tabanıyla eğitti ve bu sayede 2020 yılında CASP yarışmasında %90’ın üzerinde bir başarı elde edilmiş oldu.
Hassabis ve Jumper, AlphaFold2’nin gerçekten işe yaradığını doğruladıklarında insanda bulunan tüm proteinlerin üç boyutlu yapısını oluşturdu. Ayrıca şimdiye kadar keşfedilen 200 milyon proteinin neredeyse tamamının yapısını tahmin ettiler.
Bir yandan da daha önce CASP yarışmalarına katılan ve rakiplerine kıyasla büyük başarılar elde eden Baker, geliştirdiği yazılımı ters yönde kullanabileceğine dair bir fikir geliştirdi. Amaç, üç boyutlu protein yapısından farklı amino asit dizileri oluşturmaktı. Böylece yeni tür protein yapıları oluşturmak mümkün olabilirdi.
Yöntem işe yaradı ve 2003’te Baker ve ekibi doğada daha önce görülmemiş benzersiz bir yapıya sahip ‘’Top7’’ adını verdikleri bir protein üretti. Baker’ın laboratuvarı, o zamandan beri birden fazla grip virüsü türüyle savaşabilecek peptitlerden mikropların atmosferden karbondioksiti emme yeteneğini artırabilecek yeni enzimlere kadar birçok yeni protein üretmeye devam ediyor.
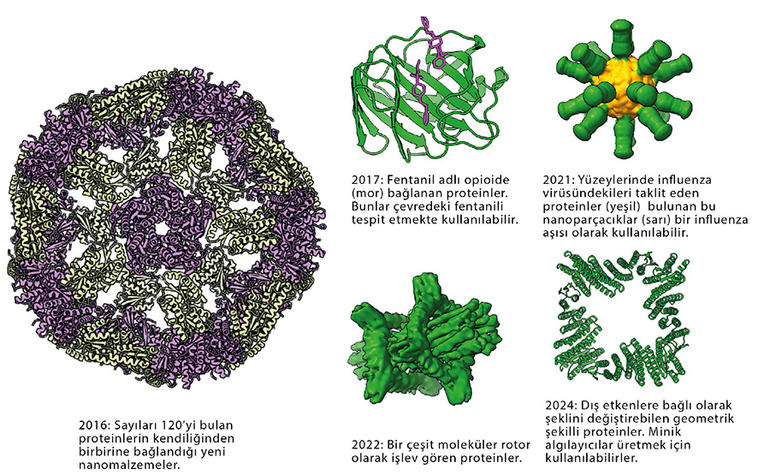
Terezia Kovalova/The Royal Swedish Academy of Sciences
Baker’ın Rosetta programıyla geliştirilmiş proteinler
Kaynaklar: